イオン結合の組み合わせ
化学式とは、(化学)物質をそれを構成する元素を使って表したもので、分子からなる物質を表す化学式を分子式(ぶんししき、molecular formula)、イオン物質を表す化学式をイオン式(いおんしき、ionic formula)と呼ぶことがある。
組成式と構造式
物質の元素組成を示す組成式と、分子構造を表示する構造式とに分類される。前者はもっぱら化学量論に基づく化学方程式の中などで使われて量的関係を示すことが多く、後者は分子構造を図示したり、反応機構を説明する化学反応式などで反応に特有な構造やそれに関連した性質を示す場合に利用することが多い。
化学式 - Wikipediaより引用
イオン結合
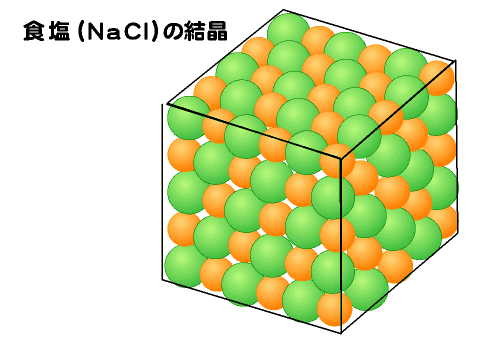
イオンになりやすい物質どおしは、陽イオンと陰イオンが電気的な力(静電気的に引力)で結びついている。
そのため、固体や液体の場合には、ひとつの物質として見出せないため、組成式で表す。気体の場合は、たとえば塩化ナトリウム(NaCl)は共有結合性のある分子として存在していることが確認されている。
イオン結合の物質の表し方
イオン結合でできた物質を組成式で表すとき、陽イオンの価数と陰イオンの価数が一致する最小の整数比で表す。
それぞれのイオンの化学式に着目
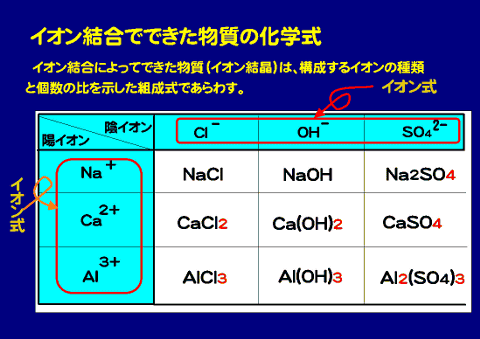
| 陽イオン\陰イオン | Cl- 塩化物イオン |
OH- 水酸化物イオン |
SO42- 硫酸イオン |
|---|---|---|---|
| Na+ | NaCl 塩化ナトリウム |
NaOH 水酸化ナトリウム |
Na2 硫酸ナトリウム |
| Ca2+ カルシウムイオン |
CaCl2 塩化カルシウム |
Ca(OH)2 水酸化カルシウム |
CaSO4 硫酸カルシウム |
| Al3+ アルミニウムイオン |
AlCl3 塩化アルミニウム |
Al(OH)3 水酸化アルミニウム |
Al2Cl3 硫酸アルミニウム |
係数の出し方と元素の数
イオン式・組成式の係数を出すときは、それぞれのイオンの最小公倍数を求めて、それをそれぞれのイオンの価数で割る。
係数の計算方法
Al3+と(SO4)2+の場合
- 価数が、3と2であることから、その最小公倍数を求める。
3と2の最小公倍数は、3×2 = 6 - その数を課数で割るとそのイオンの係数がわかる。
6(最小公倍数) ÷ 3(Al3+の価数) = 2 ・・・ Al3+の係数
6(最小公倍数) ÷ 2((SO4)2-の価数) = 3 ・・・ (SO4)2-の係数 - 以上から
Al2(SO4)3 ・・・・イオン結合物質の化学式
(それぞれの元素の存在比)・・・ひとつの構成単位に含まれる元素の数は、
- Al--------- 2個 2
- S --------- 3個 1×3
- O ---------12個 4×3

.gif)
イオン結晶
結晶とは、構成する要素が規則正しく整列した固体で、その要素がイオンであるものをイオン結晶と言う。イオン結晶の場合は組成式で表す。
イオン結晶の固体は、(イオン結合の物質は、)水のような極性溶媒中には、イオンを生成して溶けるため、その溶液は電気を通す。また、イオン結合の物質は液体になると電気を通すことができる。
イオン結合は水に溶けやすい物が多い。
イオン結合でできているものの多くは水に溶ける。水に溶けないものは次の共有結合性が強かったり(ヨウ化銀・臭化銀)、電気陰性度の差が水のそれと大きく異なる(フッ化カルシウム)場合である。
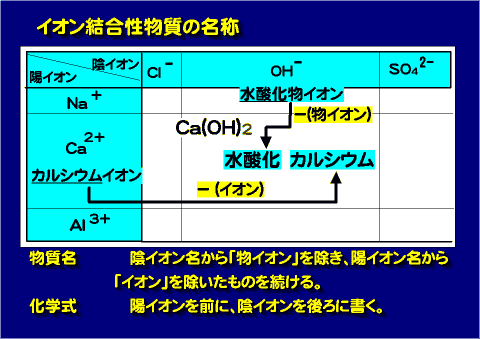
イオン結合性物質の化学式の書き方
- 陽イオンを前に書く
- 複数の金属元素がある場合はアルファベット順。
- 非金属元素は次の順番で書く。
- B, Si, C, Sb, As, P, N, H, Se, S, I, Br, Cl, O, F
12.化学式の種類と書き方等を参考にすること。