共有結合(covalent bond)
金属のように電子を失いやすい(イオン化エネルギーの小さい)ものと、電子を欲しがっている(電子親和力の大きな)ものは、イオン結合をすることを学んだ。では、電子を欲しがっている(電子親和力の大きな)もの、すなわち非金属元素どおしは、どのようにして結合するのであろうか?
単体の共有結合
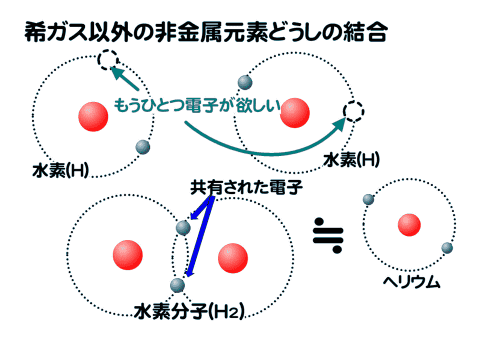
水素の場合は、最外殻のK殻に2個の電子が入って安定するので、もうひとつの水素原子の電子を共有することで結合する。
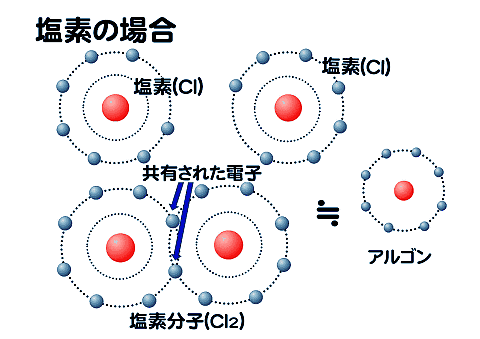
同様に塩素の場合も、最外殻(L殻)の電子を共有して結合する。
非金属元素同士の結合
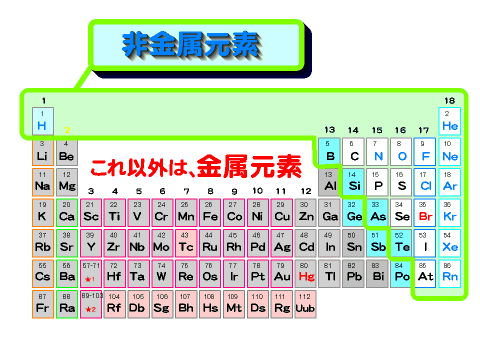
周期表で右上に位置する希ガスを除いた非金属元素と水素(黄色の部分)の原子は、最外殻の電子を共有することで結合する。

このように、希ガスを除く非金属元素同士の場合は、元素が自身または他の原子がもつ電子を共有することで、希ガス型の安定した電子配置になることで結合が行われます。このように電子を共有することで行われる化学結合を共有結合という。
どの原子が使われるか?
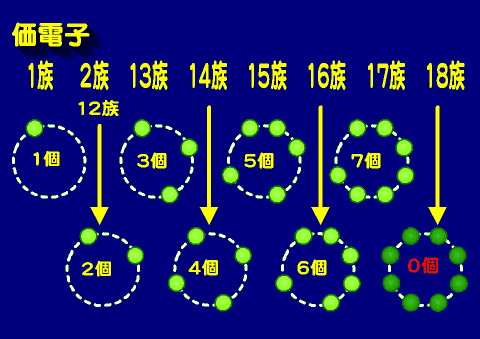
ここで周期表とその電子がどのように軌道を埋めていくか見ながら、共有結合に使われる電子について見てみよう。ここで、原子の最外殻に存在し化学結合に使われる電子を価電子という。
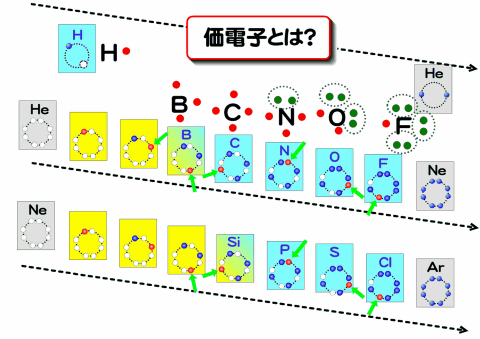
族と価電子の関係
このように、典型元素では族数が増えるごとに、価電子の数はひとつずつ増えていく。12族以降は10引いて数えると良い。