周期表と元素
元素記号の見方
元素記号は活字体で書き、最初の文字は大文字で書く。筆記体で書かない。
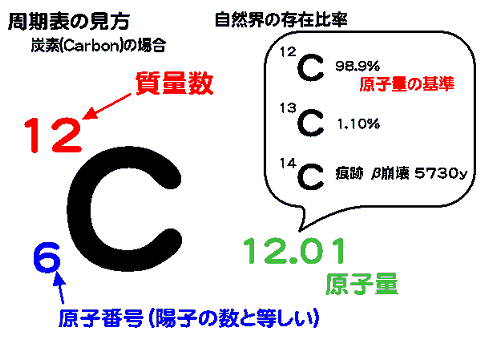
質量数と原子番号
元素記号の左上には、質量数を書き、左下には原子番号を書く。原子番号はその元素の持つ陽子数に等しい。質量数は、陽子と中性子の数の和に等しい。
原子(Atom)の構造と周期表
原子の構造
原子は中心にある原子核(atomic nucleus)と周囲に存在する電子(electron)でできている。
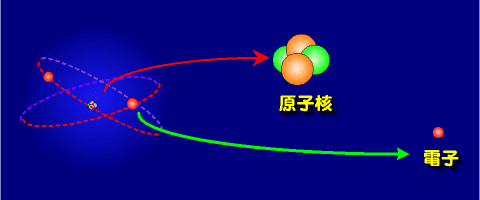
原子核の直径は原子の直径の一万分の一しかない。ほとんど空っぽ状態である。
原子核
原子核は、陽子(proton)と中性子(neutron)で構成される。
構成素粒子の大きさと質量
電子
電子の質量は、9.1093826×10−31キログラム。直径は不明【測れない】
陽子
陽子の質量は、1.672210x10-27kgで、電子質量の1836.14倍に相当する。直径は10-13cm。
中性子
質量は1.6749×10-27kg (939.573MeV) と陽子よりわずかに大きい。直径は10-13cm。
原子の質量の大部分は核に存在する。
質量数12の炭素12Cは1961年にIUPACよって質量の基準とすることが決定され、アボガドロ数などの基礎的な定数はこれによって算出されている。
放射性元素と核分裂
ウラン(原子量238.028)には、238Uが、99.2742%、核分裂を起こす235Uが、0.7204%含まれている。
放射性同位体のアルファ崩壊、ベータ崩壊については、教科書の171ページを参照する。なお、原子番号83(ビスマス)以降の元素は放射性同位体しか存在しないため放射性元素といわれる。
2011年3月11日の東日本大震災に伴う福島第一原子力発電所の事故に関連して、放射線、放射性元素、核分裂については詳しく説明する。
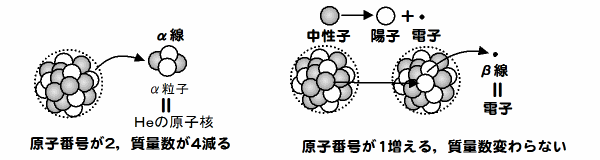
- 崩壊・・原子核がα線やβ線を出して他の核種に変化すること。
- 自然に崩壊する元素を放射性元素という。ビスマス以上の重い元素はすべて放射性元素である。
- 放射性元素は崩壊して他の元素に変わるが、その量が半分になる時間を半減期という。
- 核分裂・・・原子核が二つ以上の殻に分裂すること。中性子を受け取って不安定になって分裂するものがある。、
- 連鎖反応・・・分裂したときに中性子を2個以上放出する場合、その2個が次の原子核に補足されるとねずみ算式に反応が連続する。
- 中性子は高速すぎると弾き飛ばされるので減速させる必要がある。それに使われる物質を減速材という。
減速材は中性子を補足しないもので、(弾き飛ばされない)軽い元素がよい。 - 核分裂で生じた熱を吸収して取り出す物質を冷却材という。
マジックナンバー
核子(陽子と中性子)の数が、「2」、「8」、「16」、「20」、「28」、「50」、「82」、「126」個ののとき、原子核は安定なことが知られています。
陽子はプラスの電気を帯びているので、陽子と陽子は互いに反発し合ってくっつきません。それをくっつけているのが中性子で、中性子があることで「核力」という電気の反発力よりケタ違いに「強い力」で互いに結びついている。
そこで、核子の数が「2」、「8」、「16」、「20」、「28」、「50」、「82」、「126」個ののときに安定になる事が知られています。これを安定原子核のマジックナンバーといいます。「マジックナンバー2」はヘリウム4つまりアルファ粒子で陽子2個と中性子2個、合わせて4個が集まっています。(ここでは陽子数=中性子数になっています。)
原子番号が大きくなって、陽子の数が多くなると、電気的反発力も強くなってゆきます。それに逆らって核を1つにまとめるためには、中性子の数をだんだん多くして、核力も強くする必要があり、その安定の目安がマジックナンバーです。上に記したように82と126はおのおのマジックナンバーで、2つを足した鉛208はとても安定な元素として知られています。
- 核分裂(235U)の例
- 235U + n → 95Y + 139I + 2n
| 生成物 | 収率 | 半減期 | 特記 |
|---|---|---|---|
| セシウム133 | 6.79% | 安定 | 一部は中性子捕獲により半減期約2年のセシウム134になる |
| ヨウ素135 | 6.33% | 6.57h | 崩壊で生成するキセノン135は原子炉でもっとも主要な毒物質で10-50%が中性子獲得によりキセノン136になり、残りは半減期9.14hでセシウム135になる。 |
| ジルコニウム93 | 6.30% | 1.53My | |
| セシウム137 | 6.09% | 30.17y | |
| テクネチウム99 | 6.05% | 211ky | |
| ストロンチウム90 | 5.75% | 28.9y | |
| ヨウ素131 | 2.83% | 8.02d | |
| プロメチウム147 | 2.27% | 2.62d | |
| サマリウム149 | 1.09% | 安定 | 主要な毒物質のひとつ |
| ヨウ素129 | 0.66% | 15.7My |
ここまでのまとめ
ここまで学んだことの重要な項目を並べておく。そのすべてについて、完璧に説明できるように
- 物質は混合物と純物質に分けられる。
- 純物質とは、どの部分を取り出しても性質が同じもの。
- 同じ純物質でも結びつき方で異なる性質を持つものがある。純物質の場合同素体という>
- 純物質には単体と化合物がある。
- 物質はわずかな種類の元素(Element)から構成されている。
- 元素の実体は原子(Atom)である。
- その物質の構成要素を示す場合は元素という。
- 物質である場合は単体という。
- 元素は陽子の数(原子番号)で区別され、約110種類あり、元素記号であらわす。
- 元素記号の最初のみ大文字
- 原子は陽子と中性子からなる原子核と周囲の電子で構成される。
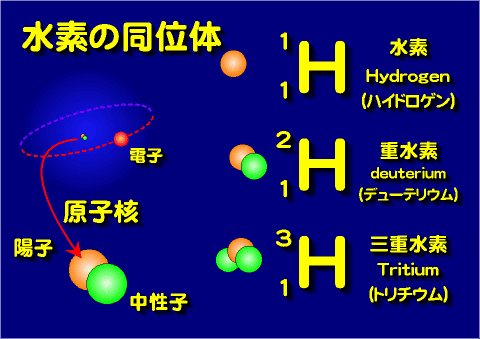
- 陽子数が同じ(化学的性質が同じ)でも中性子の数が異なると質量数が変る。
- 陽子数が同じで質量数が異なる原子を同位体(アイソトープ)という。
- 自然界に存在する元素の原子量は複数の質量数の原子の平均値で決まる。
- 核分裂
- 原子には核分裂をするものがある。
- α崩壊は原子番号、質量数がそれぞれ2,4減少する。
- β崩壊は原子番号が1増えるが、質量数は変わらない。
- 崩壊する元素は放射性元素と呼ばれる。
- 核分裂とは原子核が二つ以上に分列する。(通常崩壊は含めない)
- 中性子を吸収して核分裂を起こし、そのときに2個以上の中性子を出すものは連鎖反応を起こす。
- 原子は持っている陽子の数によって化学的な性質が決まる。
- 元素はその化学的性質によっていくつかのグループに分けられる。
- アルカリ金属、アルカリ土類金属、ハロゲン、金属元素、非金属元素、遷移(金属)元素、典型元素・・・
- 日本語では、GENSOとGENSI・・違うのは語尾の母音だけなのだが、示している概念は違う。元素(Element)と原子(Atom)
周期表
これは、Wikipediaの周期表- Wikipediaより引用したもの、周期表中のリンクはWikiの該当ページにリンクしています。
周期表 - Wikipediaより引用
1 18 1
H2 13 14 15 16 17 2
He3
Li4
Be5
B6
C7
N8
O9
F10
Ne11
Na12
Mg3 4 5 6 7 8 9 10 11 12 13
Al14
Si15
P16
S17
Cl18
Ar19
K20
Ca21
Sc22
Ti23
V24
Cr25
Mn26
Fe27
Co28
Ni29
Cu30
Zn31
Ga32
Ge33
As34
Se35
Br36
Kr37
Rb38
Sr39
Y40
Zr41
Nb42
Mo43
Tc44
Ru45
Rh46
Pd47
Ag48
Cd49
In50
Sn51
Sb52
Te53
I54
Xe55
Cs56
Ba*1 72
Hf73
Ta74
W75
Re76
Os77
Ir78
Pt79
Au80
Hg81
Tl82
Pb83
Bi84
Po85
At86
Rn87
Fr88
Ra*2 104
Rf105
Db106
Sg107
Bh108
Hs109
Mt110
Ds111
Rg112
Uub113
Uut114
Uuq115
Uup116
Uuh117
Uus118
Uuo*1 ランタノイド: 57
La58
Ce59
Pr60
Nd61
Pm62
Sm63
Eu64
Gd65
Tb66
Dy67
Ho68
Er69
Tm70
Yb71
Lu*2 アクチノイド: 89
Ac90
Th91
Pa92
U93
Np94
Pu95
Am96
Cm97
Bk98
Cf99
Es100
Fm101
Md102
No103
Lr
1 常温で固体 金属元素 アルカリ金属 1 常温で液体 半金属元素 アルカリ土類金属 1 常温で気体 非金属元素 ハロゲン 人工元素 希ガス 遷移元素
電子の配置
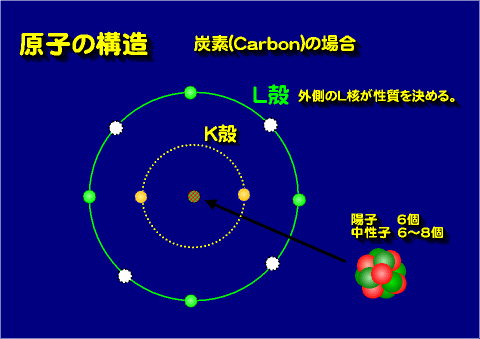
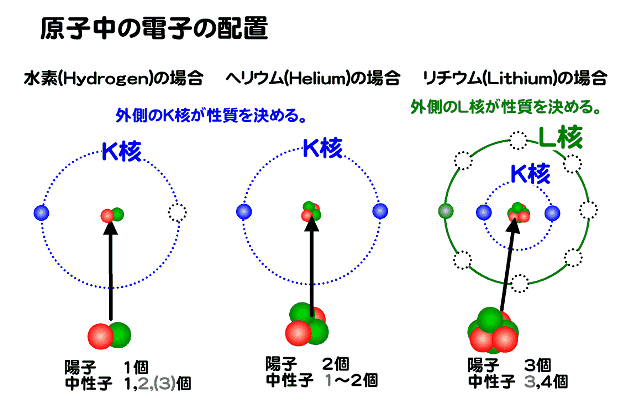
電子は原子番号(陽子の数)の順に増えていく。そのときに原則として内側の軌道から埋められていく。電子の軌道は内側から、K核, L核, M核, N核と呼ばれる。
それぞれの軌道に入る電子の最大数は決まっている。たとえばK核は2個、L核は8個というふうに・・・。
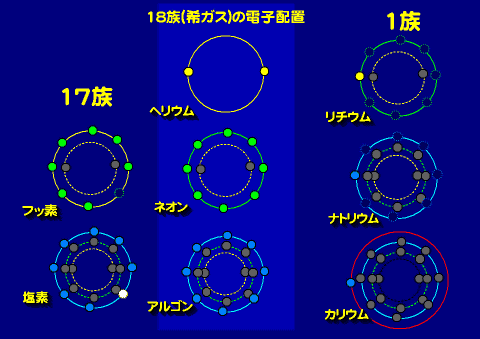
周期律表の右端の希ガス類は最外殻の電子数が8個であり、その形がその周期では最も安定している。アルカリ金属やアルカリ土類金属、ハロゲン、酸素族の性質は「希ガスのどちら側に位置するか?」「電子が何個、追加あるいは取り除かれると希ガスと同じ電子配置になるか?」で性質が決まると考えてよい。
最外殻の電子数
改めて、希ガスの最外殻の電子配置を見てみるとこのようになっている。
| 元素 | 電子核の電子の数 | |||||
|---|---|---|---|---|---|---|
| K | L | M | N | O | P | |
| 2He | 2 | |||||
| 10Ne | 2 | 8 | ||||
| 18Ar | 2 | 8 | 8 | |||
| 36Kr | 2 | 8 | 18 | 8 | ||
| 54Xe | 2 | 8 | 18 | 18 | 8 | |
| 86Rn | 2 | 8 | 18 | 32 | 18 | 8 |
K,L,M,Nとは・・
ボーアの原子模型における量子論において、電子が原子核の周囲を運動しているときに、その電荷の加速度運動に由来する電磁波を放出して電子が原子核に落ち込まない理由として電子の取りうるエネルギーの値が段階的になる(量子化)説明がされたとき、従来から知られていた元素のX線吸収・放射スペクトルのK系列,M系列を準用したため。
なんで8個なの??
それぞれの核のうち8個(正確には2個+6個)は、最も外側にあるのでこれによって化学的な性質の多くが決まる。
価電子
このように最外殻の電子が8個でないものは、その電子(とその軌道)がその元素の化学的な性質を決定する重要な役割を持っている。この電子を価電子と呼ぶ。
典型元素が典型元素たる由縁
典型元素は、最も外側にこれら8個(1周期は2個)の電子軌道が位置しているために、縦の列(族)にある元素の最外殻の電子の数は同じであるために、縦に似た元素が並ぶ。言い換えれば典型的な周期性を示すため典型元素と呼ばれる。
遷移元素
ちなみに遷移元素(遷移金属)は、この軌道以外の軌道が外側に届くため典型元素のように縦によく似た性質の元素が並ぶことは少ない。
