テルミット反応
物質量の考え方の必要性を理解するために、物質が変化したときの物質の量の導入として、また酸化還元反応の一例としてテルミット反応の実験を行う。
物質の量
食塩と砂糖どちらがたくさん水に溶ける?
ここからは、量を扱うため、必然的に計算がでてくる。わからなくなったときは、必ず聞くこと。計算自体は小学校レベルの算数であるが、引っかかってしまうとずうっと尾を引く。
原子量
最初の頃に学んだ周期表の見方(下記)をまず思い出そう。
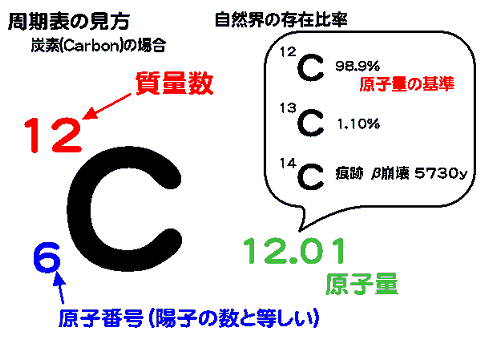
質量数・原子量・分子量・式量などは、それぞれの質量の大きさを12C原子の質量を12として比較した比例値である。(よって単位は無い)
分子量と式量
物質を構成する粒子には、単原子のものは希ガスくらいしかなく、基本的に他の元素と結びついている。その場合の重さを考えてみよう。
化合物の重さ
化合物の重さは、その物質を構成する元素の原子量の総和で示す。その物質の構成によって組成式、分子式などを使い分ける。
今まで登場した化合物について、12Cの重さを12としたときの、これらの物質の重さを比で表して見る。
水素
水素(気体)H2という分子を構成しているので、水素の原子量:12.001を2倍する。
1.008 × 2 = 2.016
窒素
窒素(気体)N2という分子を構成しているので、窒素の原子量:14.01を2倍する。
14.01 × 2 = 28.02
酸素
酸素(気体)O2という分子を構成しているので、酸素の原子量:16.00を2倍する。
16.00 × 2 = 36.00
アンモニア
アンモニアはNH3という分子を構成しているので、窒素の原子量:14.01と水素の原子量1.008から。
14.01 + 1.008 × 3 = 17.03
分子量
このように、共有結合で結びついた分子を構成している物質については、分子量を用いる。ここで言う重さは12Cとの重さの比のこと。
気体の重さ
私たちが呼吸している空気は窒素75.5%, 酸素23.0%, アルゴン1.2%(いずれも体積)の混合気体だとして、次の気体の重さを比較してみよう。
水素, 二酸化炭素, ヘリウム, プロパン(C3H8), 二酸化硫黄(SO2)
なお、それぞれの元素の原子量は次の値を使う。
水素(1.0), ヘリウム(4.0), 炭素(12.0), 窒素(14.0), 酸素(16.0), 硫黄(32.1), 塩素(35.5), アルゴン(39.9)
とき方
- 空気を構成する気体分子の分子量を求める。
- それぞれの体積比から、空気の式量・平均分子量を求める。
- 比較する気体の分子量を求め、比較する。
気体を構成する分子は、希ガスの場合は単原子分子であり、他の単体は2原子分子である。
実際に解いてみる。
- 空気を構成する気体分子の分子量を求める。
- 窒素は2原子分子なので、分子量は[原子量]×2であるから、
- 14.0 × 2 = 28.0 ・・・・ 窒素分子の分子量
- 同様に酸素は、
- 16.0 × 2 = 32.0 ・・・・ 酸素分子の分子量
- アルゴンは希ガスなので単原子分子であるから分子量は
- 39.9 ・・・・・・・・・・ アルゴンの分子量
- それぞれの体積比から、空気の式量・平均分子量を求める。
- 空気の組成比は[N2 75.5]:[O2 16.0]:{Ar 39.9]であるから
- ( 28.0 × 75.5 + 32.0 × 28.0 + 39.9 × 1.0 ) ÷ 100 = 28.3 ・ 空気の平均分子量
- 比較する気体の分子量を求め、比較する。
- それぞれの分子量を求める。
- 1.0 × 2 = 2.0 ・・・水素の分子量
- 12.0 + 16.0 × 2 = 48.0・・・二酸化炭素の分子量
- 4.0 ・・・ヘリウムの分子量
- 12.0 × 3 + 1.0 × 8 = 44.0・・・プロパン(C3H8)の分子量
- 35.5 + 16.0 × 2 = 69.5・・・二酸化硫黄(SO2)の分子量
このように分子量を知ることで、その気体の重さを比較することができる。
では、次の有毒ガスに遭遇したとき、上に逃げればよいか下に逃げればよいか考えてみよう。それぞれの気体の空気に対する比重を求めて答えなさい。(空気の密度は上の値を使う。)
一酸化炭素(CO)、二酸化イオウ(SO2)、硫化水素(H2O)
気体の量
ところが気体の場合は、気体を構成する粒子(分子)間に力が働いていないために気体の場合は同じ体積なら同じ数の粒子(分子)を含む。よって気体においては、その粒子(分子)の重さがそのまま気体の重さとして現れる。詳しくは後で気体の性質として学ぶ
固体と液体の量
すべての物質には重さ(質量)があるが、実際に物質を比べてみるとその重さ(質量)には統一性がないように見える。たとえば周期表で29番の銅(Cu)の原子量は63.5で次の、亜鉛(Zn)の質量数は65.4であるのに、それの金属(固体)の比重は、銅は8.94で亜鉛は7.14で、亜鉛のほうがずっと軽い。しかし、これは今まで学んだように原子が固体になるときの原子・分子間を結び付けている力や、詰め込まれ方(充填)が異なるためである。
物質の量を比較するために物質量という基本単位を使用する。