共有結合のでき方
共有結合を作る元素とその電子
以上を元に、分子が作られる場合について再確認してみよう。
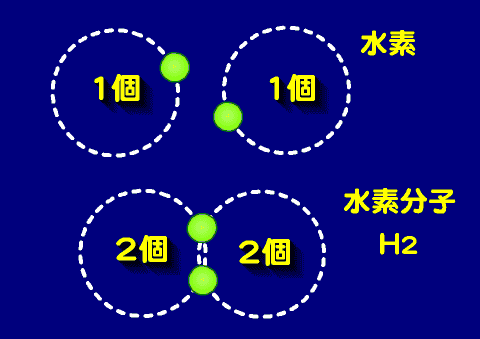
- 水素分子(H2)
- ヘリウム(He)の最外殻電子は2個であるが、水素はひとつであるため、そ一個を共有することでヘリウム方の電子配置になる。
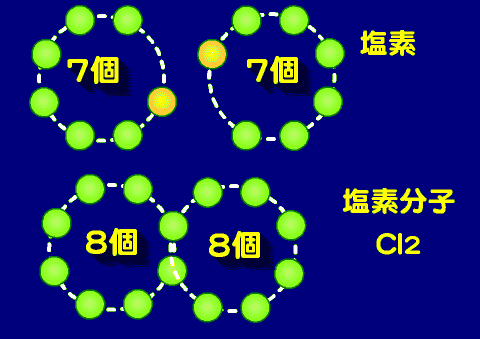
- 塩素分子(Cl2)
- 価電子の数は7個であるので、共有結合に関わる電子は1個(原子価は1)、その一個を共有して塩素分子を作る。
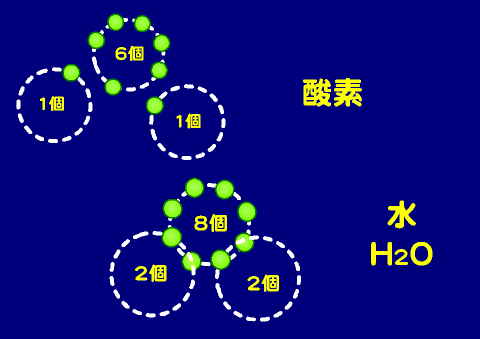
- 水(H2O)
- 酸素の価電子の数は6個であるので、共有結合に関わる電子は2個(原子価は2)、その一個を水素と共有して水分子を作る。
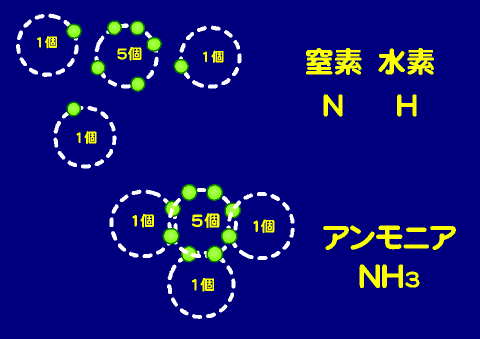
- アンモニア(NH3)
- 価電子の数は5個であるので、共有結合に関わる電子は3個(原子価は3)、その一個を水素と共有してアンモニア分子を作る。
- メタン(CH4)
- 価電子の数は4個であるので、共有結合に関わる電子は4個(原子価は4)、その一個を水素と共有してメタンア分子を作る。
希ガスを除く非金属元素の単体はこのようにして分子を作る。