化学変化(物質の変化)
ここまでは、物質そのものは変化しない場合について学んできた。これからは、物質がその結びつき方を変える、すなわち他の物質に変化することを学ぶ
- 状態変化
- 物質の構成要素は変化しないで状態が変化する。
- 化学変化
- 構成要素が変化する。
- 物質は、ひとつ以上の原子が色々な方法で結びついている。その結びつき方が変わることで他の物質に変化する。
物質の変化
化学変化 (Chemical reaction)・・・・・・・・・化学反応(Chemical change)
- 燃焼
- 錆 (金属の酸化) 金属の精錬 (金属の還元)
- 陶磁器の窯焼き
- 石鹸の製造
- 加熱による調理 タンパク質の変成などは化学変化
- 腐敗 発酵
- 呼吸 消化
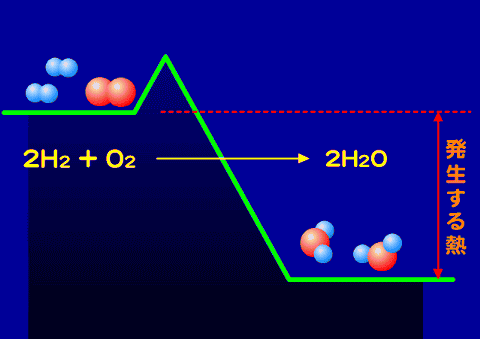
化学反応に伴う熱の出入
物質を構成する原子やイオンの組み合わせが変化して別の物資になることを化学変化(化学反応・反応)という。この変化が起きるときに熱の出入りを伴う。Activation_energy.gif
一般に物質が溶けるときは吸熱反応であるが、硫酸や水酸化ナトリウムなど水と反応する物質では発熱する場合もある。
化学変化に置いても、熱の出入を伴う。
燃焼と爆発
一般的には、可燃物質と酸素の化合、特にその内、発熱と発光を伴うものを指す事が多いが、発熱を伴う化学反応全版を言うこともある。また、生体内での穏やかな酸化反応を燃焼ということもある。この燃焼反応を含めてより激しいものを爆発と総称する。
爆発の種類
爆発(ばくはつ)とは、急速な膨張を言い、一般的には気体の急速な熱膨張を指す。燃焼による爆発の内、膨張速度(炎の伝播速度)が音速に達しないものを「爆燃(ばくねん)」、膨張速度が音速を超えるものを「爆轟(ばくごう)」と呼んで区別することがある。
このように、化学変化による熱の放出は、状態変化によるものよりも大きなものがある。化学変化による物質の変化と熱の出入りについて詳しく学ぶ。
化学反応式とは
この化学変化を、式で判りやすく表したものが化学反応式である。ここで、簡単な化学反応を例にして化学反応と化学式について学ぶことにする。
燃焼と化学反応式の書き方
まず、ごく一般的な燃焼についてその反応と、反応の表し方について学ぶ。
化学反応式の書き方
化学反応式の説明。
物質の燃焼と化学反応式
化学変化を化学式であらわしたものを化学反応式という。化学反応式において、左右の辺に含まれる原子の種類とその数は同じである。
- 反応前の物質と反応後の物質とを左右に書き分ける
- 反応前と反応後とを示すため、矢印を使用する。
- 反応前の物質を反応物、反応後の物質を生成物という。
- 反応物や生成物が複数ある場合には + で繋ぐ。
係数の決め方
化学反応式を化学式を用いて書く場合には、正しい係数が必要であるので、それについて学ぶ。
係数の求め方(右)は重要
係数の求め方
- 両辺でひとつの物質にのみ含まれる元素に着目して係数を決める。
- 係数が決まったものから数えていない元素の数を求め、その値から反対の辺のその元素を含む物質の係数を決める。
- 最後に整数に直す。
化学反応式と係数
実際の例を元に化学式を書いてみよう。
水素と酸素の反応
水素と酸素が反応して水ができる反応について、考えてみる。
- 水素 + 酸素 → 水 ・・・・・・(1)
- のように、反応前の物質反応物を左辺に、反応で生成する物質生成物を右辺に書き、反応方向を矢印(→)で示す。
- ここで、水素、酸素は分子として存在する単体であるので、
- ■H2 + ■O2 → ■H2O ・・・・・・(2)
- と書く。この場合左右の元素の数を比較すると、左辺の水素原子(H)は2個、酸素原子(O)は、2個であり、右辺の水素原子の数は2個であるが、酸素原子の数は1個しかなく、式の左右で一致しない。
- ここで右辺をそのままで、酸素の数を合わせると
- 1H2 + ½O2 → 1H2O ・・・・・・(3)
- 2H2 + O2 → 2H2O ・・・・・・(4)
とすると、両辺とも水素原子2個、酸素原子1個となる。そこで、分数を整数にするためにすべての項を2倍する。
メタノールの燃焼
より複雑な例として、メタノール(CH3OH)が燃焼する化学反応式を考えてみよう。メタノールの化学式は、CH3OHである。
- ■CH3OH + ■O2 → ■CO2 + ■H2O ・・・・・・(1)
- ここで、化学反応式と係数の「(1)両辺でひとつの物質にのみ含まれる元素に着目して係数を決める。」より、とりあえず、CH3OHの係数を1と仮定する。
- 1CH3OH + ■O2 → 1CO2 + 2H2O ・・・・・・(2)
- 右辺のすべての項が決定されたので、右辺の酸素原子の数を数えると、4個であることが判る。左辺についてみると、すでに決定されているCH3OHに1個含まれているので、
- 1CH3OH + 3/2O2 → 1CO2 + 2H2O ・・・・・・(3)
- すべての係数が決まったので、すべての原子の個数を数えておくと、両辺とも炭素原子1個、水素原子4個、酸素原子4個である。最後に分数を整数に直すため、すべての項を2倍する。
- 2CH3OH + 3O2 → 2CO2 + 4H2O ・・・・・・(4)
化学反応式が示すもの
この化学反応式で次のことがわかる。
- 2分子のメタノールと3分子の酸素から2分子の二酸化炭素と4分子の水ができる。
- 2molのメタノールと3molの酸素から2molの二酸化炭素と4molの水ができる。
- メタノール64gと酸素96gから、88gの二酸化炭素と72gの水ができる。
これらから、メタノールの比重(0.79 (20 ℃) g/cm3)から、メタノール81mlを完全に燃焼させるためには、酸素が3モル、すなわち標準状態で67.2リットルの酸素が必要なことなども、計算できる。
このように、化学式が正しく書け、物質の量が理解できていれば、化学反応における物質の変化のみならず、色々な物理量とのかかわりも求めることが可能となる。
【練習問題】
- 次の反応の化学式を書け
- エタノールの完全燃焼。
- ブタン(C4H10)が燃焼して水と二酸化炭素ができる。
- ナトリウムが水と反応して水素が発生する
- 水酸化カルシウムと塩化アンモニウムが反応して気体が発生する。
□NH4Cl +□Ca(OH)2 → □CaCl2 +□H2O +□NH3
- 灯油C12H26(比重0.80、分子量170)1Lを燃やすと、何gの水ができるか?
- 熱を発生する反応と熱を吸収する反応をそれぞれふたつ書け。
- 塩化ナトリウム100gを水400gに溶かした。この食塩水の密度は1.15g/㎝3である。この食塩水のモル濃度を答えよ。